摘要:聚乙烯基吡咯烷酮(PVP)是一种水油两亲性高分子聚合物,在医药、医疗器械、个人护理用品、工业等领域有着广泛的应用。目前主要的成膜材料是聚砜家族,PVP是血液透析膜生产中的重要成膜组分。概述了PVP的合成、分子结构、物理化学性质及其在血液透析膜中的多重功效,包括调节透析膜孔径,改善透析膜表面粗糙度,调节透析膜表面电位,改善透析膜生物相容性等作用。
关键词:聚乙烯基吡咯烷酮;PVP;血液透析膜;致孔剂;形貌调节;亲水改性
聚乙烯基吡咯烷酮(PVP)是一种乙炔化学产品,最早由德国化学家WalterReppe于1938年发现,是一种由1-乙烯基-2-吡咯烷酮单体合成的线性聚合物。自PVP出现以来,由于其优异的油水双亲特性、良好的化学稳定性、极高的生物相容性、较强的与疏水物质亲和力,而被广泛应用于制药工业、医疗器械、膜工业、新能源电池行业、纳米材料制备、食品加工、胶黏剂、个人护理用品、牙膏、洗涤剂、光学和电气应用、造纸、印染、涂料、油墨、纤维和纺织材料、陶瓷、金属涂层、光刻和摄影、冶金淬火液与切削液、钻井完井液、天然气输送等领域[1-3]。PVP在血液透析膜制造领域中是不可或缺的高分子材料,本文主要概述了PVP的合成、分子结构、物理化学性质及其在血液透析膜中的多重功效。

1PVP合成途径及主要性质
1.1PVP的合成
PVP是以N-乙烯基吡咯烷酮(NVP)为前体,采用本体聚合、溶液聚合或乳液聚合合成。乙炔和甲醛是N-乙烯基吡咯烷酮合成的起始原料,通过催化醛加成生成1,4-丁炔二醇;1,4-丁炔二醇催化加氢生成1,4-丁二醇;1,4-丁二醇催化脱氢成环生成γ-丁内酯;γ-丁内酯氨化生成α-吡咯烷酮;α-吡咯烷酮进行炔加成生成N-乙烯基吡咯烷酮[4]。在经典合成途径的基础上,逐渐演化出了1,4-丁二醇法、γ-丁内酯法、α-吡咯烷酮法合成N-乙烯基吡咯烷酮,实质上都是在经典合成途径上的进一步演变。
在聚合生成PVP的过程中,NVP单体在水中或有机溶剂中具有不同的聚合反应方式,并产生相应的封端产物。在水中聚合的PVP具有羟基和羰基封端,封端的乙醛基团更活泼;引发剂过氧化氢浓度与所得聚合物的分子链长度呈负相关,即过氧化氢浓度越高,聚合产物的相对分子质量越低。NVP在醇类、甲苯等有机溶剂中聚合遵循更复杂的过程,聚合得到的PVP具有脱氢后的溶剂和氢封端,更不易水解,结构及性质更稳定[5]。
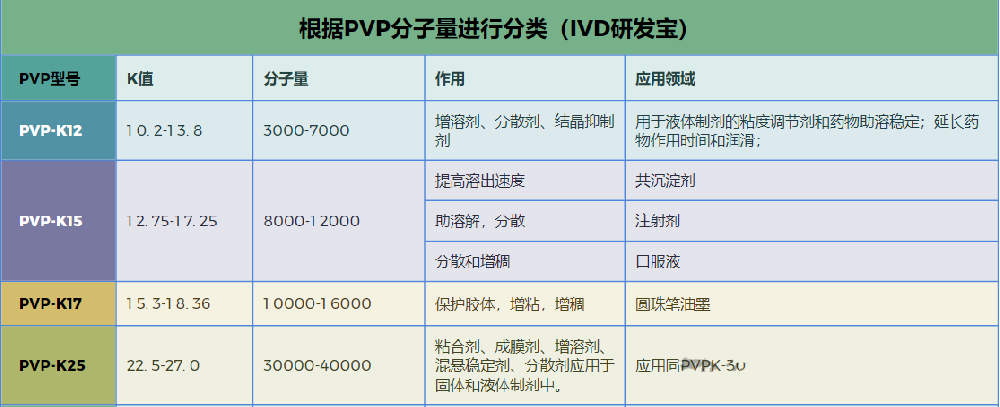
1.2PVP的性质
PVP是水油双亲、非离子性高分子聚合物,具有相对分子质量分布范围广、无毒、生物相容性好、化学惰性、耐高温、pH值稳定、水溶液无色等特性。PVP粉末为白色或淡黄色,具有极强的吸湿性,最高可达90%(质量比)。其水溶液无色透明、略带特征型气味。PVP在不同溶剂中的溶解性不同,在所有常规溶剂中的溶解度优异,广泛应用于所有剂型药物的生产中。
PVP相对分子质量越高,堆密度越小;相对分子质量越高,分子链越长;接枝程度越高,分子之间堆积时,相互之间形成的空隙越大。
2血液透析膜
血液透析膜是血液透析的核心组件,透析膜主体材料经历了由纤维素/改性纤维素,向高分子合成聚合物的发展历程,科研工作者在改善生物相容性方面做出了一系列努力。传统纤维素膜由于只能够清除血液中的小分子,且易激活补体,而逐渐被改性纤维素代替。补体受体C5a、C5b、C3b、C3c是触发补体激活、不良反应的主要因素。改性醋酸纤维素、合成纤维素的出现,有效减少了膜表面可能与补体受体结合的大部分游离羟基,提高了膜体的生物相容性。
2.1血液透析膜的材质
合成聚合物膜的主体材质包括聚砜(PSU)、聚醚砜(PES)、聚甲基丙烯酸甲酯(PMMA)、聚酯聚合物合金(PEPA)、聚丙烯腈(PAN)、聚碳酸酯(PC)、聚酰胺(PAM)和乙烯-乙烯醇共聚物(EVAL)等。与纤维素/改性纤维素膜相比,这些膜在物理化学性质方面的优势更明显,包括孔径更大、渗透性更好、过滤能力和溶质去除能力进一步提高[6]。与具有对称结构的纤维素膜不同,合成聚合物膜具有不对称结构。与血液接触的支撑层外部由多孔表皮组成,作为溶质分离屏障,该层的内部呈高密度特性。支撑层提供机械稳定性,并具有显微镜下可见的海绵状或手指型结构[7]。
目前血液透析膜使用的高分子合成聚合物主体材料中,聚砜家族处于垄断地位,占比93%,其中71%为PSU、22%为PES,这主要是因为聚砜家族聚合物具有更高的机械强度、热稳定性、抗溶胀性、易加工性以及耐化学侵蚀性[8]。进一步研究表明,PSU/PES的血液相容性较好,只表现出轻微的补体激活、较少的白细胞数量下降、以及较低的白细胞酶释放[9]。聚砜家族的垄断地位在对国际、国内龙头企业市售透析膜的研究中得到进一步印证,国内外部分企业透析膜参数见表1[10]。并且在这些市售产品中,PVP也是透析膜骨架材料中首选的致孔剂、形貌调节剂、亲水改性剂。
表1国内外部分企业透析膜参数
图片
2.2血液透析膜的制备原理
相分离(或相转化)是膜形成的基本原理,聚合物以受控方式从液体向固态转变。相转化是一种物理现象,凝固过程通常是由从一种液态转变为两种液态(液-液解混)开始的,它是通过添加非溶剂使溶解在连续相溶剂体系中的聚合物反转为固体大分子网络,留下多孔的固体“支架”。该过程通过选择合适的高分子聚合物和调控各种工艺参数,来实现适合特定分离应用所需的膜结构。
典型情况下,铸膜溶液(初始浇注溶液)是通过溶解主体聚合物聚砜和PVP在二甲基乙酰胺(DMAc)中制备的。在相转化过程中,水作为溶剂来控制聚合物的沉淀和凝固,用于膜纺丝过程高分子聚合物的比例、精确的热力学条件决定了最终的膜结构。
3PVP在血液透析膜中发挥的作用
3.1PVP对膜的致孔、形貌调节作用
PVP借助其极强的水溶性,在膜凝固、溶剂与非溶剂发生双向扩散的进程中,能够改善非溶剂在铸膜液中的传质速率,加速凝胶沉淀,造成瞬时分相,有利于膜表面孔结构的形成。通过改变所使用的PVP的相对分子质量,或调节PVP在铸膜液中的比例,来获得满足需求的膜形貌。
BARZIN等[14]研究了PES和PVP百分比变化对透析膜形态和性能的影响。当PES浓度增加,PVP浓度降低时,膜结构从指状结构向海绵状结构转变。大孔结构能够提高肌酐、尿素和尿酸的通透性。研究人员也描述了类似的观察结果,向PES铸膜液中添加2.8%PVP后,所得透析膜指状孔结构变大、数量增多,肌酐、尿素和尿酸的清除率显著提高。张露等[15]以PES为膜材料,采用不同相对分子质量的PVPK60、PVPK90为添加剂,添加PVPK60的膜外表面平均孔径及开孔率较大;PVPK90/PVPK60共混膜的外表面平均孔径与开孔率均不低于纯PVPK90所得膜,其中共混比为4/1的膜外表面平均孔径高于纯PVPK60所得膜;共混比为2/3的中空纤维膜为全海绵状结构且含水量较高。曹原[16]研究了PVP对PES膜孔径大小及分布、支撑层膜孔结构、抗污性能的影响。PVP的加入使得PES膜表面膜孔数量先增加后减少,支撑层指状孔比例提高,贯通性更好,孔径分布更均匀。
3.2PVP对改善透析膜生物相容性的作用
当PSU/PES透析膜与血液接触时,血液中的血清蛋白(例如纤维蛋白原)会吸附在膜表面并产生变性,血液中的血小板会进一步黏附在变性蛋白上,进而形成血栓。当膜表面存在亲水性PVP时,该材料表现出对生物分子团簇的抵抗作用。这是由于PVP极强的亲水性,使水分子与PVP络合形成水合层,血液中的游离水与水合层表层的临近水和多层水之间的强烈相互作用,降低临近蛋白质团簇的表面亲和力,从而抵抗血清蛋白、血小板在膜表面的吸附堆积,抑制血栓的形成。
3.3PVP对膜表面电荷的影响
膜表面的性质是膜与血液之间相互作用的重要影响因素,对补体激活、蛋白质吸附、血栓形成和免疫反应等产生影响。膜表面的电荷分布是表征膜表面性质、血液和透析膜之间相互作用的重要特征之一。Zeta电位是研究膜表面荷电性的重要参数,其能够反映膜表面电荷性质及分布[18]。
PVP的羰基、叔氨基在溶液中极化后会带有负电荷。在制模过程中,占添加总量20%~30%的PVP在相转化过程中迁移到膜的内表面(与血液接触的面),导致膜表面负电荷增加。这有利于防止血液中大多数带负电荷的蛋白和带负电荷的红细胞在膜表面堆积,抑制血栓生成。另外在透析过程中,膜表面的负电荷能够选择性吸附血液中某些异常升高的蛋白质、毒素和药物。YIN等将乙烯基吡咯烷酮-丙烯腈-乙烯基吡咯烷酮三元共聚物与PES混合制成透析膜,血小板黏附从100%降低到0.5%,并归因于添加剂的亲水性和阴离子特性。TANG等[21]利用丙烯腈-乙烯基吡咯烷酮-丙烯酸三元共聚物贡献的阴离子特性将血小板吸附从142降低到30(1×104细胞/cm2)。LIU等将PES膜与乙烯吡咯烷酮-丙烯酸共聚物与BSA接枝,以最大限度地减少血小板吸附。
3.4PVP调节膜表面粗糙度
透析膜表面粗糙度与红细胞破裂有关,粗糙度越高,越易导致红细胞破裂。红细胞破裂会刺激血小板黏附和蛋白质吸附,从而导致生化级联的激活,降低透析膜的生物相容性[23]。
BARZIN等[24]通过原子力显微镜(AFM)研究了PVP对透析膜内表面粗糙度的影响,结果表明,较低的PVP含量和较高的热处理温度,能够获得较平滑的透析膜内表面。该结构能够有效提高超滤性能和降低血液中蛋白在膜表面的吸附。ABDELRASOUL等[25]采用PVP修饰PES膜表面,使用AFM、SEM对修饰前后的膜表面进行观察,结果发现,经PVP修饰的膜表面更加光滑。以未经修饰的PES膜为对照,发现黏附在PVP修饰表面的纤维蛋白原更少,生物相容性显著提高。
4展望
PVP在多年的实际应用中,已经被充分证明是一种不可或缺的成膜助剂,能够改善透析膜的生物相容性、调节膜体结构。然而PVP的轻度补体激活特性仍需持续改进。可以通过以下几种方式提高PVP的应用特性:①研究可控相对分子质量分布范围的PVP,改进聚合工艺,降低NVP、α-吡咯烷酮等杂质的含量。②进一步研究不同相对分子质量PVP在制膜过程中的作用机制、优化PVP在透析膜配方中的比例。③PVP与其他亲水材料复配使用,以期达到复配增效的目的。④PVP的前体NVP能够与多种物质共聚,特别是嵌段共聚的方式来改善PVP的性质,进一步提高PVP在血液中的生物相容性。可备选的共聚单体有甲基丙烯酸甲酯、丙烯腈、丙烯酸、苯乙烯、乙烯基苯磺酸钠、N-乙烯基甲酰胺、N-乙烯基己内酰胺等。⑤利用PVP对纳米材料的亲和力和分散性,将纳米材料嵌入到透析膜中,改善透析膜的生物相容性。⑥使用光催化、高能射线辐照方式,将PVP固定于膜材质表面,降低其在使用过程中的溶出度。或使PVP形成微交联形态,进而形成水凝胶层,改善膜材料亲水性。