Abstract摘要
细胞和生物制品的冷冻保存是支撑所有生物医学研究的基础,不论是从常规样品存储还是到新兴的基于细胞的治疗技术,都需要细胞库提供经过验证、稳定和一致的细胞产品。
这一领域开始于60多年前,在甘油和二甲基亚砜被发现可作为冷冻保护剂而被广泛应用的时候。只不过,这两种冷冻保护剂并不适用于所有的细胞类型,也不适用于所有的细胞保存情况。
这篇综述对新的化学方法在冷冻保存领域的探索和应用研究进行了着重强调和审慎的回顾。作者总结了细胞冷冻保存过程中关键(且复杂)的损伤途径,以及针对每种损伤途径的处理方法。同时还讨论了生物仿生的方法,比如基于极端微生物的方法。
此外,作者提出了生物样本冷冻保存的两种策略:一种是基于小分子的策略,另一种是基于大分子的策略。这些策略都是通过化学介质来控制冰晶的形成,从而达到生物样本冷冻保存目的。这些化学介质包括冰结合剂、冰核生成剂、冰核生成抑制剂和尚未完全理解其机制的新材料。
最后,作者展望了冷冻保存技术未来的三个发展方向:bottom-upmolecularmodeling(自下而上的分子建模)、library-baseddiscoveryapproaches(基于库的发现方法)和materialssciencetools(材料科学工具)。这些技术都有望改变冷冻保存的策略。其中,自下而上的分子建模是一种将分子结构和性质从基本原理开始计算的方法,可以用于设计更有效的冷冻保存方案;基于库的发现方法则是通过筛选大量已知物质来寻找新的冷冻保存材料;材料科学工具可以用于研究材料的物理、化学和力学性质,从而设计出更耐用、更可靠的冷冻保存设备和材料。

Introduction介绍
冷冻保存(Cryopreservation)是在极低温的条件下储存生物样本的过程,它在基础研究、临床医学、生物医学和食品科学等领域发挥着非常重要的作用。
冷冻保存技术是通过降低温度以减缓生物样本的降解速率,从而延长生物样本储存时间的一种技术,这种技术在目前的应用非常广泛——
比如,挪威Svalbard全球种子库中数百万个种子样本就是通过冷冻保存技术进行深低温保存的,因此,冷冻保存技术对于未来的粮食安全至关重要。
另外,全世界几乎每个生物医学研究实验室都设有专门冷冻保存细胞的细胞库,以避免细胞在连续培养过程中发生表型漂移,同时保存备份细胞和难以获得的有价值或稀有细胞,例如特定的原代细胞和临床样本。
保存卵子、精子和胚胎等的辅助生殖技术,彻底改变了因某些特殊原因(如某些癌症及对癌症的相关治疗)而丧失生育能力患者的体外生殖治疗方式,使个体的生育能力得以维持更长时间。
新近,冷冻保存技术为癌症治疗提供了创新疗法,如过继性细胞疗法。通过将患者的血液样本或生物组织运送到专门的细胞制备和储存机构保存,以供未来治疗使用。这些免疫疗法为难治性癌症的患者提供了更有希望的治疗手段。同时,新的组织和器官保存技术的应用研究也正在兴起,如果研究能取得成功,将解决器官移植的长时间等待问题。
最后,COVID-19新冠病毒的大流行已经证实,冷冻保存技术对于确保经冷链运输的疫苗的有效性至关重要,特别是对于需要超低温保存的疫苗而言,如基于mRNA技术的疫苗。
上述所有应用场景中,冷冻保存技术对于生物样本的长期储存和最小化功能损失是不可或缺的。当然,我们还需要一种低温或非低温的方案来短时间保存细胞,例如将细胞固定在水凝胶中,但这不在这篇综述的讨论范围中。
在超低温条件(低于-130°C)下,生物样本内的动能和分子运动减少,化学和生物反应的速率变慢,代谢、活性运输、酶反应和扩散等过程也会减缓,使得材料能够保持悬浮状态直到温度再次升高。然而,冷冻和解冻过程会对样本造成损伤,因此需要使用冷冻保护剂(CPAs)来减轻这种损伤。常用的CPAs包括二甲基亚砜(DMSO)和甘油,它们已经被广泛用于研究和临床应用中。红细胞使用20-40%的甘油进行冷冻保存,永生细胞系常规存储在10%(v/v)的DMSO中,而用于临床移植的细胞,包括造血干细胞和嵌合抗原受体(CAR-T)细胞,通常在5-10%的DMSO中进行冷冻保存。
尽管这些常见的冷冻保护剂及其配方非常有用,但是它们在冷冻保存生物样本时存在一些问题,一些特殊的细胞系在被冷冻和解冻后难恢复其细胞功能,比如人类胚胎干细胞(hESCs)、单层细胞系统和多细胞系统。储存在甘油中的红细胞需要一个较长时间的去甘油过程,才能保证其在去除冷冻保护剂的同时不发生渗透性休克。DMSO已被证明会导致肝组织微小结构发生表观遗传变化,诱导胚胎干细胞分化,并可能导致细胞储存袋中的增塑剂渗出。此外,DMSO可能会对接受冷冻保存移植物的患者产生不良反应(尽管移植的临床收益超过不良反应)。总体而言,需要设计开发和探索新的冷冻保护剂,以替代或减少当前冷冻保护剂金标准所需的量,并解决多细胞系统和整个器官等具有挑战性样本类型的冷冻保存。
Challengesduringcryopreservation
冷冻保存过程中遇到的挑战
在探讨冷冻保存的新化学方法之前,需要先理解与冷冻保存相关的挑战。
第一个挑战:
大多数情况下,如果将细胞溶液的温度冷却至平衡冰点以下,会不可避免地造成细胞溶液中冰晶的形成,并降低溶液中水分子的占比。
而这会导致两种后果。
首先,细胞膜内外之间会形成渗透压,从而造成细胞脱水(图1)。对需要冷冻保存的生物样本而言,一定程度的脱水是有益的,因为它减少了细胞内过多冰晶形成(IIF)的可能性(这些冰晶往往是致命的)。但是,过度脱水也是冷冻保存过程中造成生物样本损伤的主要原因之一,而且这个过程还是不可逆的。
第二种情况是,随着细胞外冰晶的不断增加,细胞溶液中的水分子会越来越少,而溶质的浓度则会越来越高。在冰晶和水混合溶液中的细胞,将暴露在比没有冰晶溶液更高的溶质浓度中。而这将造成对细胞毒性的增加,最终导致细胞渗透性休克(一种由于细胞外溶液的渗透压突然改变导致细胞内外水分迅速流动,从而引起细胞结构和功能紊乱的现象)。

图1冷冻保存过程中细胞损伤的潜在机制
当常温状态下的细胞为了冷冻保存而被降温,或是已冷冻的细胞被解冻复温,都会面临一些风险:降温过程中,胞外冰晶的形成将导致细胞内外渗透压失衡——胞外溶质浓度高于胞内,从而使水分子从胞内流向胞外,即脱水。在没有细胞外冰晶的情况下,细胞会被快速降温至平衡冰点以下,从而增加致命冰晶形成的可能性。通过快速降温速率和添加高浓度的冷冻保护剂(CPA),可以实现无晶体结构的非晶体状态,即玻璃化。然而,高浓度的CPA可能对细胞有毒。在解冻复温过程中,冰晶可能会重新形成,形成的冰晶会造成细胞损伤或裂解。玻璃化的样本可能变得不稳定,并发生脱玻璃化,导致冰晶的重新形成。最后,冷冻保存可能会导致解冻后细胞凋亡,并延迟解冻后细胞的死亡。请注意,这些都是极端情况,不一定会同时发生,并且可以通过添加冷冻保护剂来避免一些情况的发生。为了更直观,冰晶的大小不是按比例绘制的。
第二个挑战是冷冻保存过程存在的样本降温过快问题,即细胞溶液的温度在胞外冰晶形成前冷却到比平衡融点还要低好几摄氏度。
当冰晶形成时,放热过程会释放潜热,从而使溶液温度先是升高至接近融点,然后再慢慢继续下降。因此,当此前过快降温的溶液重新回调到(升温后的)溶液温度时,它要比正常温度下形成冰晶的细胞溶液需要更大的降温冷量。通常,在接近零摄氏度的温度条件下诱导细胞外冰晶的形成,会让细胞脱水,从而降低致命的胞内冰晶形成的可能性。
第三个挑战是如何找到能让细胞存活率最高的降温速率,即最佳降温速率。
较慢的降温速率(<1℃/min )可以让细胞有足够的时间脱水并防止胞内冰晶形成。但是,慢速降温(例如,<1℃/min)会使细胞长时间暴露在高浓度溶质和有毒的冷冻保护剂中。相反,快速降温(例如,>100℃/min)避免了细胞在高溶质溶液中的长时间暴露,但却会因为细胞无法快速脱水而使胞内冰晶形成,从而造成细胞不可逆的损伤。
Mazur提出双因素假说,阐述了可获得高存活率的细胞最佳降温速率——即中等降温速率,在慢速降温和快速降温之间进行平衡,从而实现最高的细胞存活率。需要强调的是,根据双因素假说,不同类型细胞的最佳降温速率是不相同的。
尽管Mazur提出的双因素假说似乎很完美,但它还是存在一个需要注意的地方。在极高的降温速率下,晶态冰形成的过程可能会被跳过去,直接形成超高粘度的玻璃,称为玻璃化(图1)。这可以防止冷冻保存过程中由冰晶成核和细胞内冰晶形成引起的细胞损伤。然而,玻璃化通常需要非常高浓度的冷冻保护剂,而高浓度冷冻保护剂加入和去除的过程,可能会对细胞产生渗透压应力(指细胞内外溶质浓度差异导致的生物体内的压力,可能影响细胞的生长和生存),从而对细胞造成损伤。
第四个挑战发生在冷冻保存的生物样本解冻复苏的过程中。
首次,脱水的细胞暴露于大量水或缓冲溶液中,细胞外水分子过快穿过细胞膜进入细胞内,可能会导致细胞胀裂。
其次,复苏过程中,还会发生胞内冰晶的形成。甚至,小冰晶还会被较大晶体吸收形成更大冰晶(奥斯瓦尔德成熟:一种在溶液、凝胶或固体中颗粒生长的现象,较大颗粒通过吸收较小颗粒的物质而增长,从而导致颗粒尺寸分布变得更加不均匀),从而造成细胞损伤或渗透应力。
再次,在解冻过程中,玻璃化溶液有发生脱玻璃化的风险,即形成冰晶。更深入地讲,冷冻和解冻过程对细胞施加的应力,可能导致蛋白质变性,并影响细胞的内部结构,比如微管和卵母细胞中的减数分裂纺锤体。
如上这些细胞冷冻保存过程中遇到的挑战,也可以通过添加渗透性和非渗透性的冷冻保护剂(CAP)来缓解。
渗透性冷冻保护剂有DMSO和甘油,它们可以穿过细胞膜,进入到细胞中。
而非渗透性保护剂则有聚乙烯吡咯烷酮、羟乙基淀粉(HES)等聚合物材料和海藻糖等小分子物质。相较于渗透性冷冻保护剂,非渗透性冷冻保护剂无法进入细胞内,只能在细胞外。
个别冷冻保护剂的作用机制目前仍未完全阐明,一般认为,大多数冷冻保护剂对细胞的保护作用是由多种因素构成的。比如氢键的调控,对细胞膜的影响,低溶质效应和低温下溶液粘度的增加等。
Chemicaltoolsforcryopreservation
用于低温保存的化学工具
为了改善冷冻保存的效果,研究人员现在不再局限于偶然发现的冷冻保护剂,而是使用了一系列技术、工具和方法,比如仿生合成设计、分子建模和新兴的探索工具。在接下来的部分,作者回顾和批判性地分析其中的一些进展,并重点介绍化学工具在现有和新兴领域的应用。
(一)玻璃化冷冻保护剂
目前临床上首选玻璃化冷冻法作为卵母细胞和胚胎的冷冻保存方法(vitrification),据相关报道称,相较于慢速冷冻(slow-freezing),玻璃化法冷冻保存的细胞,临床效果更好。
玻璃化l冷冻法是一种快速冷冻技术,即将样本迅速冷却至极低温度,使其变得像玻璃一样的固态,从而避免了冰晶对细胞的损伤。玻璃化冷冻法可用于大容量样本的冷冻保存,也可用于整个器官的冷冻,而这是慢速冷冻无法实现的。
实现玻璃化冷冻,需要高浓度的渗透性和非渗透性冷冻保护剂,如乙二醇,丙二醇,糖类,DMSO和高分子化合物,以及快速的冷却速率,从而使冷冻样本跳过冰晶形成的阶段。
相较于慢速冷冻,玻璃化冷冻法也存在缺点——高浓度冷冻保护剂的毒性,以及解冻过程需要快速并分步去除冷冻保护剂,以避免解冻后冷冻保护剂毒性对样本细胞造成损伤。
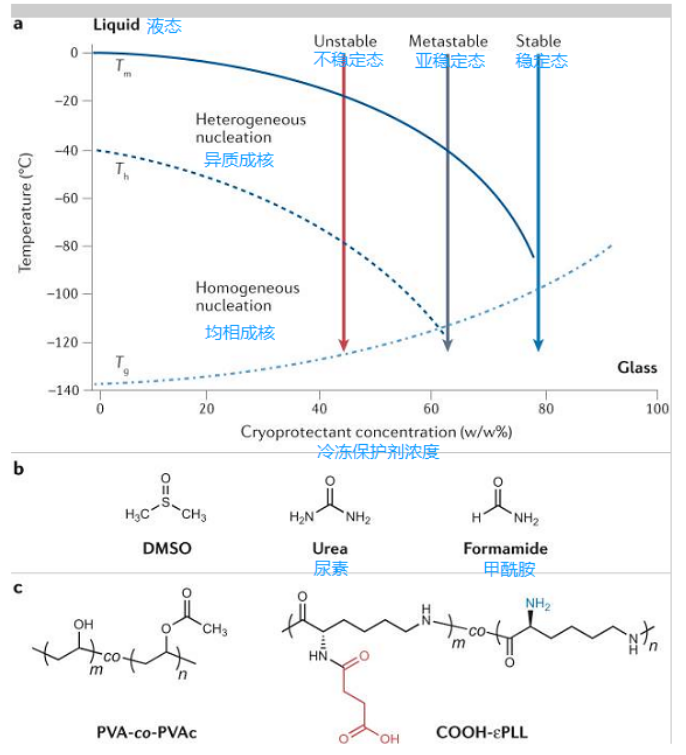
图2玻璃化冷冻保护剂
要实现玻璃化冷冻,样本必须被冷却到形成无异质、玻璃化非晶体状态(通过外来颗粒物)或均质(通过水分子的随机排序)的冰核。实现玻璃化冷冻,需要使用一些小分子化合物,如二甲基亚砜(DMSO)、尿素或甲酰胺,以及大分子化合物,如聚乙烯醇-共-聚乙烯酸酯(PVA-co-PVAc)共聚物和羧基化ε-聚-L-赖氨酸(COOH-εPLL),以防止样本在加热过程中发生去玻璃化反应。
a|示意样本水相图,其中含有不同浓度的冷冻保护剂。Tm和实线表示平衡融化温度,Th和虚线表示均相冰晶形成温度,Tg和虚线/虚点线表示样本的玻璃化转变温度。对于冷冻保护剂含量较低的样本(<40%冷冻保护剂),由于形成冰晶的概率较高,所以难以实现玻璃化。
b|已被研究用于毒性中和的小分子结构:二甲基亚砜(DMSO),尿素和甲酰胺。
c|高分子化合物,如聚乙烯醇-共-聚乙酸乙酯(PVA-co-PVAc)共聚物和羧化的ε-聚-L-赖氨酸(COOH-εPLL),已被用于防止样本在升温过程中发生去玻璃化。
本文分析了冷冻保存过程中,不同渗透性冷冻保护剂混合物对兔肾皮质切片细胞活力(K+/Na+比值)的影响。研究发现,渗透性冷冻保护剂的毒性与保护剂中水和极性基团间的氢键有关。
研究人员筛选出了新的玻璃化冷冻保护剂,它们的总体浓度比标准玻璃化冷冻保护剂高,但固有毒性却较低,可以提高K+/Na+比值。
有趣的是,玻璃化冷冻中使用的一些渗透性冷冻保护剂(如甲酰胺)的毒性可以通过添加DMSO、尿素和乙酰胺等化合物来降低(图2b)。这种方法被称为冷冻保护剂毒性中和。
研究人员推测,这些小分子可能起到甲酰胺低毒性类似物的作用,但竞争实验驳斥了这个推测。相反,这种中和作用的产生被认为是减少了非特异性毒性,从而降低化学物质对细胞的损伤。这些研究表明,加入小分子化合物可以辅助解决冷冻保护剂的毒性问题。
科学家们除了研究减轻毒性的方法外,还探索了降低冷冻保护剂总浓度的方法。
在小体积样本中,温度传导距离较短,因此在仅添加少量冷冻保护剂的情况下,可以通过较高冷却速率来实现在玻璃化转变温度(Tg)下的快速冷却,并且不会形成冰晶。
用1.5M丙二醇和0.5M海藻糖,将密封在直径为70μm的AML-12肝细胞液滴玻璃化冷冻,解冻复苏后,其细胞存活率约为90%多;使用3T3小鼠成纤维细胞的喷墨打印进行高通量玻璃化冷冻,可实现低(冷冻保护剂)浓度的冷冻保存。
另据报道,通过对只有皮升(一种体积单位,等于升的十亿分之一)体积大小的样本进行超高速率的冷却,可实现不添加冷冻保护剂的玻璃化冷冻。采用不添加冷冻保护剂、超高冷却速率的冷冻方法,对小鼠肌球(C1C12)细胞和原代大鼠干细胞进行冷冻保存,解冻复苏后,细胞的存活率为70-80%,这和传统的冷冻保存方法差不多。
然而,这些方法虽然在研究方面显示出巨大的前景,但是在需要用到大量细胞的细胞治疗应用方面,却可能并不实用。
此外,解冻复苏过程也面临和冷冻降温过程同样的问题——如何跳过冰晶形成阶段,直接由固态变为液态。
常规的外部加热方法虽说对冷冻保存样本的解冻有用,但是外部加热会有个问题——外部加热法对冷冻保存的样本来说,加热是不均匀的,从外向内存在由高往低的温度梯度。这会让样本外部先于内部解冻,从而导致冰晶的形成。
纳米加热技术利用磁性纳米颗粒在交变磁场中的局部加热效应,实现均匀快速复温。应用介孔硅包覆的铁氧化物纳米颗粒有助于猪动脉组织(体积为20mL)的冷冻保存,而磁铁矿(Fe3O4)纳米颗粒则使人类诱导多能干细胞(hiPSCs)的细胞存活率从38.5%迅速提高到74.8%,这是通过Hoechst/SYTOX绿染色法在解冻后即时进行检测的。微孔硅包覆的铁氧化物纳米颗粒提高了大鼠肾脏等大样本的冷冻保存效果。此外,纳米加热技术还可将玻璃化的藻酸盐封装干细胞的集落附着率从24%提高至68%。
冷冻降温时防止大冰晶形成的冷冻保护剂,也可以在解冻复苏期间减少冰晶形成对细胞造成的损害。
使用聚乙烯醇-共聚乙酸乙烯酯(PVA-co-PVAc)共聚物(1-3%,图2c)可以防止在56%(w/w)乙二醇和DMSO溶液中发生的去玻璃化反应。
由乙酸乙烯酯和乙烯醇按20:80的比例组合而成的共聚物(冷冻保护剂)效果最佳,说明添加剂分子结构的重要性,以及PVA独特的冰结合性能。在35%(w/w)1,2-丙二醇水溶液中添加3%(w/w)PVA可抑制冰核形成和冰晶增长。
此外,羧基化的ε-聚-L-赖氨酸(COOH-εPLL,图2c,在“大分子冷冻保护剂”部分有更详细的论述)也显示出作为玻璃化溶液添加剂的前景。添加10%(w/v)的COOH-εPLL在含有6.5M乙二醇和0.75M蔗糖的溶液中,可以使hiPSCs成功被玻璃化冷冻。并且解冻复苏后,细胞集落的附着率从46.8%提高到73.4%。COOH-εPLL的作用机制目前尚未完全弄清楚,但通过差示扫描量热法(DSC,一种用于测量物质在加热或冷却过程中吸收或释放热量的实验技术)分析观察到,它似乎可以降低渗透压或抑制去玻璃化。据报道,在成功玻璃化冷冻的人胚胎干细胞、猪胚胎和3D细胞构造方面,使用COOH-εPLL也有类似的效果。
Chemicaltoolsforcryopreservation
用于低温保存的化学工具
为了提升冷冻保存的效果,研究人员现在不再仅依靠偶然发现的冷冻保护剂,而是采用了一系列的技术、工具和方法,比如仿生合成设计、分子建模和新兴的探索工具。在接下来的内容中,研究者回顾并分析了其中的一些进展,并重点介绍化学工具在现有和新兴领域中的应用。
(二)冰晶重结晶抑制剂
冰晶重结晶现象,是奥斯特瓦尔德成熟的一种类型,是指在已冻存的细胞中,小冰晶会随着时间推移而逐渐增大,并与其它小冰晶融合形成更大冰晶的现象。冰晶重结晶是冷冻保存细胞在解冻复苏时死亡的主要原因,它还会引起细胞的渗透压应力。
抑制冰晶重结晶活性的冰结合蛋白有很多种,包括抗冻糖蛋白和合成冰晶重结晶抑制剂。抗冻糖蛋白在0.022µg/mL的浓度下可抑制冰晶的增长,其抑制效力比最好的合成冰晶重结晶抑制剂(IRIs)还要高好几个数量级。
1992年,Carpenter和Hansen发现,从美洲拟鲽(Pseudopleuronectesamericanus,鲽科下的一种比目鱼)提取的抗冻蛋白能减少红细胞解冻后发生的溶血现象——这是首次证明抑制冰晶重结晶有助于生物样本的冷冻保存。
在样本冷冻保存的过程中,抑制冰晶的重结晶非常重要。
但是,“需要加入多少剂量的抑制剂,才能保证冷冻保存过程中不出现冰晶重结晶现象呢?”
这个问题并不好回答,因为任何一种抑制剂都可能会有多种作用机制,这些作用机制可能会因细胞系、冷冻保护剂类型、冷冻保存时长或解冻时长、冷冻保存过程中其它影响因素的不同而有所不同。
这里有两点需要着重说明的。
首先,冰晶重结晶的抑制是一个需要持续很长时间的过程,而不是一蹴而就的瞬时动作。
其次,任何化合物在足够高的浓度下都可以减缓冰晶的形成。虽然抑制冰晶重结晶是保证样本冷冻保存成功的一个重要因素,但不能简单地认为样本冷冻保存成功是抑制了冰晶重结晶的缘故。因为,其它高浓度化合物也在冷冻保存过程中发挥减缓冰晶形成的作用。
聚D/L-丝氨酸和聚乙二醇(PEG)尽管抑制冰晶重结晶的效力较弱,但是高浓度(100mg/mL)的聚D/L-丝氨酸和聚乙二醇(PEG)却可以让红细胞被成功冷冻保存。
同样,oligoproline是一种弱效力的冰晶重结晶抑制剂(IRI)。但它却能够有效提升A549细胞和卵母细胞冷冻保存的成功率。只不过,证明冰晶重结晶抑制化合物与冷冻保存效力提升之间是否有因果关系并不容易。研究者猜测,一些物质的化学结构特征,比如两亲性(图3Bc,指一种分子或化合物同时具有亲水性和疏水性的特性。这种分子通常具有一个亲水性的极性头部和一个疏水性的非极性尾部;这种特性使得这种分子在水中能够形成微小的胶束结构,其中头部朝向水相,尾部朝向非水相,从而实现分子的分散和稳定。在生物学中,许多蛋白质和脂质都具有amphipathy特性,这使得它们能够在细胞膜中发挥重要的作用),可能与冰晶重结晶的抑制和冷冻保存效果的提升都有关联。
另外,研究者强调,除了冰晶重结晶外,还存在有其它的结冰效应,比如热滞后(是指物质在加热和冷却过程中呈现出不同的热力学行为的现象。具体而言,当物质在加热过程中经历相变(如从固态到液态)时,其温度与相变发生的温度并不完全一致。同样地,在冷却过程中,物质的温度也不会与相变恢复的温度完全一致。这种温度差异导致了热滞后现象)和动态成冰(这可能对样本有害)。冰结合机制的论述超出本综述范围,但可以明确的是,多种分子水平的机制可以产生这种肉眼可见的效应。


图3冰晶重结晶抑制剂
如a所示,冰晶重结晶是小冰晶增长并合成较大冰晶的过程,是奥斯特瓦尔德成熟的一种形式。冰晶重结晶抑制剂(IRIs)是减缓冰晶增长的分子和材料,例如聚乙烯醇(乙烯醇)是一种高活性大分子冰晶重结晶抑制剂(B)。冰晶重结晶抑制剂的化学结构对其功能至关重要,不同类别的设计规则可能不同。去除PVA的羟基(例如,添加更多疏水基团)或降低分子量可降低冰晶重结晶抑制活性(Ba)。o-芳基糖苷(Bb)是一种可提升红细胞冻存复苏回收率的小分子冰晶重结晶抑制剂。对这类冰晶重结晶抑制剂而言,疏水性的增加将导致其冰晶重结晶抑制活性的增加。研究发现,表面两亲性对一系列具有冰晶重结晶抑制活性的材料都非常重要,它是很多冰晶重结晶抑制蛋白和合成聚合物的共同特征,如在Bc中显示的。
相较于糖蛋白冰晶重结晶抑制剂,简化版的糖肽冰晶重结晶抑制剂更容易合成。通过特定的实验,研究者发现芳香基糖苷类冰晶重结晶抑制剂可以减轻红细胞的损伤,从而将解冻复苏后的红细胞回收率从约40%提升到超过80%。
同大分子冰晶重结晶抑制剂一样,疏水基团对小分子冰晶重结晶抑制剂来说非常重要(图3Bb)。只不过,疏水基团的位置更加重要,因为疏水性并不总是能显著增加抑制剂的活性,如疏水基团修饰的PVA(图3Ba)和氟化糖肽,其抑制活性并未显著增加。
胞内冰晶的形成对细胞往往是致命的,但是传统的冷冻保护剂可以有效抑制冰晶的形成,从而避免其对细胞造成损伤。因此,是否需要在细胞内使用冰晶重结晶抑制剂,仍是研究者们在探讨的一个问题。
研究者们发现,可渗透性冰晶重结晶抑制剂对人脐静脉内皮细胞内冰晶的增长有抑制作用(图3Bb),而重组的III型α-胎蛋白可在冷冻保存过程中对单层A549细胞起保护作用(在添加有5%DMSO的情况下,可将解冻复苏回收率从10%提升到>40%)。只不过,它只在胞外使用才有效。
有意思的是,细胞在悬浮液中进行冷冻保存,添加可渗透性冰晶重结晶抑制剂并没能带来明显的效果。研究者认为,可能是因为悬浮培养体系已被优化(可能含有冰晶重结晶抑制分子),或者是因为在悬浮液中,细胞与细胞之间、细胞与基质之间缺少接触,因而,胞内冰晶增长和冰晶重结晶不再是细胞冷冻保存过程中的主要损伤因素。
其它非渗透性的冰晶重结晶抑制剂已被证实可以缓解(但不能消除)细胞损伤,例如用于红细胞冷冻保存的PVA和用于马精子冷冻保存的氧化石墨烯。
研究者还研究了冰晶重结晶抑制剂对三种含不同糖分子的人类细胞系(WRL-68、HepG2和HEK293)解冻后细胞存活率的影响。尽管解冻后细胞存活率与冰晶重结晶抑制剂的位置有关联(在胞外还是在胞内),但是由于相对吸收量(同非渗透性的海藻糖相比,细胞内/细胞外位置)无法准确计算,所以难以评估。因此综合考虑后,可以明确的是,冰晶重结晶抑制剂可作为胞外辅助添加剂与传统的冷冻保护剂一起使用,而不是作为替代品。此外,通过添加冰晶重结晶抑制剂还可改善大鼠肺的冷冻保存效果——实验组大鼠肺受损细胞数量比对照组少了约四倍。
受到这些积极研究结果的启发,越来越多用于抑制冰晶重结晶的活性新分子和聚合物被开发出来。只是,它们的效用尚未在细胞冷冻保存过程中被评估。这些新分子和聚合物包括纳米材料、金属有机自组装体、自组装有机染料、肽和基于尼龙-3的聚合物。
最后,冰晶重结晶抑制技术被认为有助于蛋白质的冷冻保存——可减少在冷冻或解冻转变过程中的不可逆聚集,但这种技术目前只在聚乙烯醇(PVA)和自组装肽中得到验证。



